

نوع مقاله : مروری
نویسندگان
1 گروه بیمار یهای دهان و فک و صورت، مرکز تحقیقات دندانپزشکی، پژوهشکده علوم دندانپزشکی، دانشکده دندانپزشکی، دانشگاه علوم پزشکی تهران، تهران، ایران
2 گروه بیمار یهای دهان و فک و صورت، دانشکده دندانپزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران
3 گروه بیمار یهای دهان و فک و صورت، دانشکده دندانپزشکی، دانشگاه علوم پزشکی کاشان، کاشان، ایران
چکیده
کلیدواژهها
Introduction
Oral lichen planus (OLP) is a chronic mucocutaneous disease that commonly involve oral mucosa. In this disease, frequent lesions in different areas of the mouth can be seen bilaterally and mostly with a similar pattern. The World Health Organization (WHO) classifies OLP as a potentially premalignant disorder with an uncertain risk of malignant transformation, and recommends that patients should be carefully examined. Xerostomia and hyposalivation are common complications of OLP. Saliva composed of water, electrolytes and organic micro and macro molecules and plays many roles. It is one of the main factors in maintaining the health and integrity of the oral mucosa and teeth. Helping to digest food and have a sense of taste, mechanical protection of the oral mucosa, and eliminating oral microbes are other important roles of saliva. The symptoms of xerostomia and hyposalivation include bad breath, burning feeling in the mouth, trouble swallowing or speaking, and altered sense of taste. As a result, xerostomia and hyposalivation can significantly reduce the quality of life of people with OLP. The main mechanism of xerostomia in OLP patients is still unknown, and there is scant research in this field. This study aims to review the studies related to xerostomia in patients with OLP and its related possible mechanisms.
Methods
To find articles related to OLP, a search was conducted in Medline, Scopus, Embase and Web of Science databases on studies related published from 1965 to 2021 using the keywords oral lichen planus, xerostomia, hyposalivation, salivary gland hypofunction, and Oral dryness. include articles were clinical studies on the relationship between OLP and dry mouth/xerostomia with well defined study design and methodology (e.g. diagnosis of OLP by clinical and histopathological studies, use of age- and gender-matched case and control groups since they can affect the characteristics of saliva, and correct saliva extraction).
Results
In this study, 8 articles were finally selected based on entry criteria. These articles were about the histopathological examination of salivary glands, evaluation of salivary compositions, saliva flow rate assessment, and feeling of dry mouth using a questionnaire. Their specifications are presented in Table 1.

Discussion
The relationship between OLP and xerostomia has been shown in many studies. Various mechanisms have been proposed in this regard. The mentioned mechanisms were the inflammatory and autoimmune disorders of the sensory nervous system, changes in saliva composition, and changes in saliva flow rate. The changes in the surface characteristics of the oral mucosa due to the presence of inflammation cause the sensation of dry mouth in patients with OLP. It was shown that the presence of inflammation in the oral mucosa causes xerostomia even with normal saliva flow rate in patients with OLP. Chronic mucosal inflammation in OLP can endanger the integrity and function of the oral mucosa by affecting the normal absorption and secretion of mucous fluid and electrolytes, which is effective in the occurrence of xerostomia. The loss of the epithelium of the oral mucosa, which is observed in the wounds, causes disturbance in the formation of oral mucosal pellicle, which has a role in making the oral mucosa slippery. The heat associated with the inflammatory response can increase the surface evaporation of mucus and eventually cause xerostomia. Therefore, patients with OLP experience some degree of xerostomia. The control of xerostomia in patients with OLP should be taken into consideration by the clinicians; it can greatly help relieve the symptoms of OLP.
Ethical Considerations
Compliance with ethical guidelines
This article is the result of a review study and did not have any human or animal samples, and no code of ethics can be defined for it.
Funding
This research did not receive any specific grant from funding agencies in the public, commercial, or not-for-profit sectors.
Authors' contributions
Conceptualization: Agha Hosseini and Mousavi; Research and review: Agha Hosseini, Barati and Elham; Editing and finalization by Agha Hosseini, Barati, Elham and Mousavi.
Conflicts of interest
The authors declared no conflict of interest.
مقدمه
لیکن پلان دهانی، یک اختلال اتوایمیون پوستی مخاطی مزمن است که بهوسیله لنفوسیت T واسطهگری میشود [1]. این بیماری 0/5-2/6 درصد جهان را ـکه غالباً زنان بین 30 تا 60 سال هستندـ تحتتأثیر خود قرار میدهد [2]. اتیولوژی دقیق لیکن پلان دهانی ناشناخته است و تنها تعدادی فاکتور مستعدکننده در نظر گرفته شده که در پاتوژنز آن نقش داشته باشد [3]. ارتباط بین لیکن پلان دهانی با تعدادی از عفونتهای ویروسی شامل: اپشتین بار ویروس، ویروس پاپیلومای انسانی و ویروس نقص ایمنی اکتسابی نشان داده شده است، اما شایعترین شواهد مرتبط با لیکن پلان دهانی و ویروس هپاتیت C است [4].
لیکن پلان دهانی بهطور شایعی مخاط دهان را درگیر میکند، اما سایر مکانها مثل پوست، پوست سر، ناخن، آلت تناسلی مردان، واژینال، ازوفاگال و مخاط ملتحمه نیز میتواند درگیر شود [5]. ضایعات در نواحی مختلف دهان بهصورت متعدد و دوطرفه و اکثراً با الگوی قرینه مشاهده میشود. اشکال مختلف بیماری ازنظر بالینی، بهصورت رتیکولار، پاپولار، پلاک لایک، اروزیو، آتروفیک و بولوز رخ میدهد [6]. ازنظر هیستوپاتولوژیکی، توسط هیپرکراتوز، اورتوکراتوز، آکانتوز یا آتروفی اپیتلیال، دژنراسیون سلول بازال و انفیلتراسیون متراکم نواری شکل، لنفوسیتها در درم سطحی مشخص میشود [7]. سازمان بهداشت جهانی، پلان دهانی را بهعنوان یک اختلال بالقوه پیشبدخیم با خطر تبدیل بدخیمی نامشخص طبقهبندی میکند و پیشنهاد میکند که بیماران بهدقت ارزیابی شوند. درحالیکه مکانیسم ایجادکننده تغییرات زمینهای که میتواند باعث ایجاد سرطان در لیکن پلان باشد، هنوز بهدرستی شناخته نشده است [8، 9].
حس خشکی دهان و کاهش عملکرد غدد بزاقی٬ از تظاهرات و شکایات شایع همراه بیماران مبتلا به لیکن پلان دهان است. حدود 45 درصد از بیماران مبتلا به لیکن پلان دهان٬ دارای حس خشکی دهان هستند. در مطالعهای نشان داده شده است که حدود 87 درصد از مبتلایان به لیکن پلان دهان٬ دارای کاهش در میزان جریان بزاق تحریکی هستند [10]. خشکی دهان٬ اصطلاحی کلی است که بهصورت 2 اصطلاح دقیقتر حس ذهنی خشکی دهان و کاهش میزان جریان بزاق تعریف میشود. کاهش میزان ترشح بزاق به زیر حد آستانه نرمال آن برای بزاق تحریکی٬ کمتر از 0/5 میلیلیتر در دقیقه و برای بزاق غیرتحریکی کمتر از 0/1 میلیلیتر در دقیقه است. بهطور خیلی شایع اما نه الزاماً، زروستومیا و هایپوسالیویشن همزمان با هم اتفاق میافتند [11]. بزاق، ترکیب پیچیدهای از آب، الکترولیتها و میکرو و ماکرو ملکولهای آلی است. بزاق٬ نقشهای بسیاری بر عهده دارد و از عوامل اصلی در حفظ سلامتی و یکپارچگی مخاط دهان و دندانها است. کمک به هضم غذا، حس چشایی، حفاظت مکانیکی مخاط دهان و از بین بردن میکروبهای دهان، از دیگر نقشهای مهم بزاق است [12]. استفاده از نمونه بزاق در تشخیص بسیاری از بیماریها و پایش نتایج اثر داروها در درمان بیماریها در بسیاری از موارد به اثبات رسیده است [12]. علائم خشکی دهان و کاهش عملکرد بزاقی٬ شامل بوی بد دهان، سوزش و زخم دهان، سختی در بلع و صحبت کردن و تغییر در حس چشایی بیمار است [13]. درنتیجه خشکی دهان و کاهش میزان بزاق میتواند بهطورچشمگیری، سبب کاهش کیفیت زندگی افراد مبتلا به لیکن پلان دهانی شود. تا به امروز، مکانیسم اصلی ایجادکننده خشکی دهان، در مبتلایان به لیکن پلان دهانی تا حد زیادی ناشناخته مانده است و تحقیقات در این زمینه بسیار محدود است.
هدف از این مطالعه مروری، بررسی رابطه میان بیماری لیکن پلان دهانی و خشکی دهان و مکانیسمهای مؤثر در ایجاد خشکی دهان در این بیماری است.
مواد و روشها
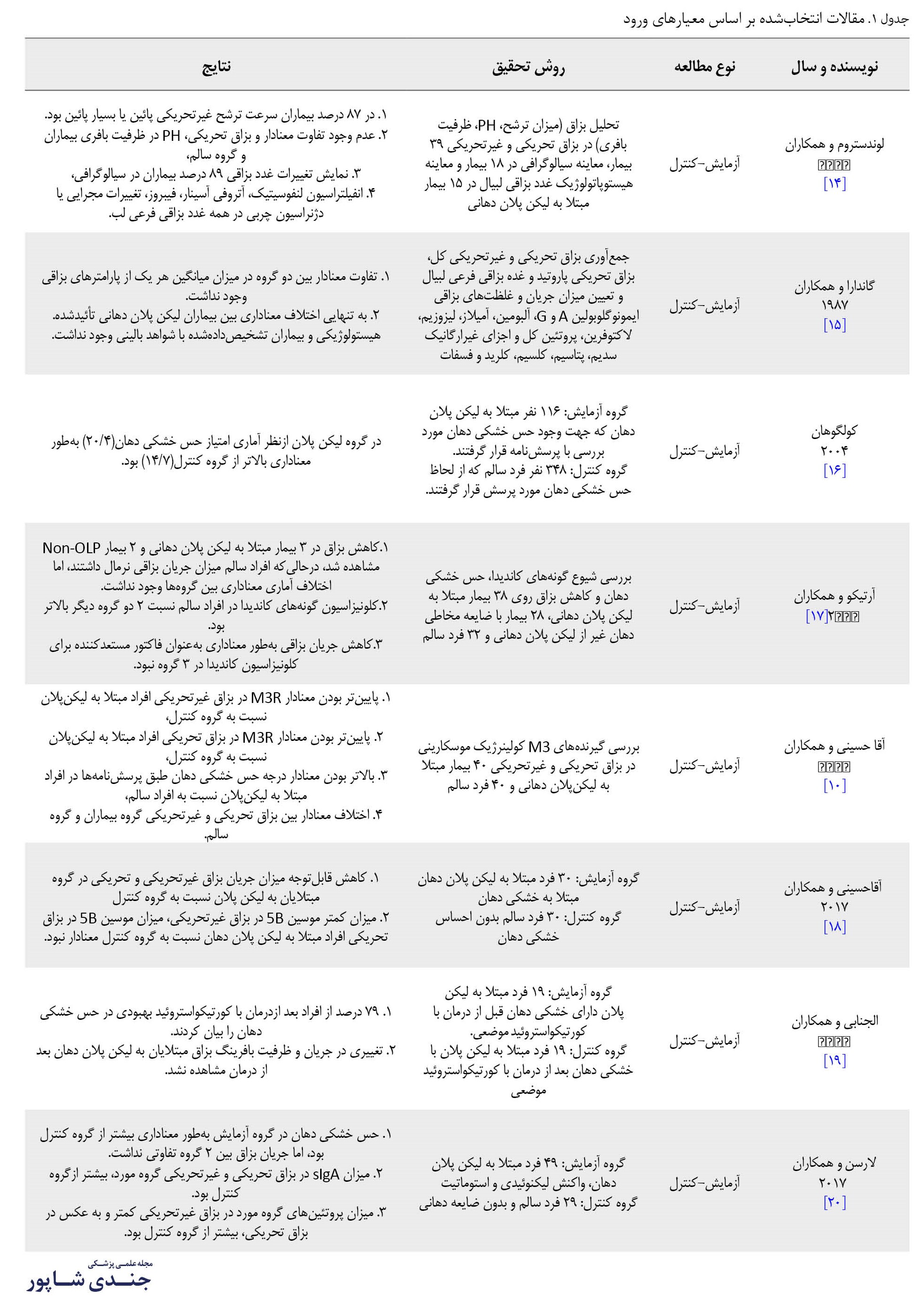
برای یافتن مقالات مرتبط با لیکن پلان دهانی و خشکی دهان، جستوجو از سال 1965 تا 2021 در پایگاههای امباس اسکوپوس، مدلاین، وبآوساینس انجام شد. کلمات کلیدی استفادهشده٬ حس خشکی دهان، لیکن پلان دهان، کاهش بزاق، کمکاری غدد بزاقی و خشکی دهان بود. از میان 28 مقاله مرتبطی که در جستوجوها به دست آمد، حدود 8 مقاله انتخاب و براساس معیارهای ورود بررسی شدند. این مقالات بهطور خلاصه در جدول شماره 1 آمده است.
معیارهای ورود
1. آن دسته از مطالعات بالینی که ارتباط بین لیکن پلان و خشکی دهان یا زروستومیا را بررسی کرده باشند.
2. روش اجرای مقاله (متد و متریال) بهدرستی طراحی شده باشد. برای مثال، ابتلا به لیکن پلان دهانی حتماً با معیارهای بالینی و هیستوپاتولوژی تأیید شده باشد، میان گروه آزمایش و کنترل ازنظر سن و جنس (ازآنجاکه بر خصوصیات بزاق اثرگذارند) همسانسازی شده باشد و در مطالعات مربوط به جریان و ترکیب بزاق، نحوه بزاقگیری نیز بهدرستی انجام شده باشد.
یافتهها
شرح مقاله
در سال ۱۹۸۲، لاندستروم و همکاران٬ مطالعهای با عنوان عملکرد و تغییرات غده بزاقی در بیماران مبتلا به لیکنپلان دهانی انجام دادند. در این مطالعه٬ تحلیل بزاق شاملRate ، pH و ظرفیت بافری بزاق تحریکی و غیرتحریکی ۳۹ بیمار مبتلا انجام شد. نتایج نشان داد ۸۷ درصد از بیماران Rate ترشح غیرتحریکی پایین یا بسیار پایینی داشتند (با میانگین ml/min 0/14 Rate). بزاق تحریکی، pH و ظرفیت بافری در بیماران و گروه سالم تفاوت معناداری نداشت. در سیالوگرافی از ۱۸ بیمار، تغییرات غدد بزاقی در ۸۹ درصد بیماران دیده شد. معاینات هیستوپاتولوژیک برای ۱۵ بیمار انجام شد که در همه غدد بزاقی فرعی لب٬ انفیلتراسیون لنفوسیتیک، آتروفی آسینار، فیبروز، تغییرات مجرایی یا دژنراسیون چربی یافت شد. درنتیجه عملکرد غده بزاقی مختل شد.کاهش محافظت غشاهای مخاطی ممکن است نشاندهنده این باشد که فاکتورهای خارجی مثل عفونتهای قارچی، آسیبهای مکانیکی، شیمیایی و الکتروشیمیایی قادر به تأثیر در دوره لیکن پلان دهانی باشد [14].
در سال 1987، گاندارا و همکاران، سیالوشیمی بزاق کل غدد فرعی لبیال و پاروتید بیماران مبتلا به لیکن پلان دهانی را بررسی کردند. برای این منظور، با معیار سن و جنس٬ بزاق کل تحریکی و غیرتحریکی، بزاق تحریکی پاروتید و بزاق تحریکی غده مینورلبیال در 25 بیمار مبتلا به لیکن پلان دهانی و 25 نفر گروه کنترل تطابق دادهشده جمعآوری شد. میزان جریان و غلظتهای بزاقی IgG و IgA، آلبومین، آمیلاز، لیزوزیم، لاکتوفرین و پروتئین کل توسط تکنیکهای تحلیل استاندارد تعیین شدند. همچنین غلظت اجزای غیرمعدنی شامل سدیم، پتاسیم، کلسیم، کلراید و فسفات اندازهگیری شد که نهایتاً اختلاف قابلملاحظهای بین بیماران لیکن پلان دهانی و گروه کنترل مشاهده نشد. این یافتهها٬ میان لیکن پلان دهانی و اختلال عملکرد بزاقی که ازنظر دیگر سالم بودند، ارتباطی را نشان نداد [15].
در سال2004، کولگوهان و همکاران مطالعهای با عنوان ارتباط بین لیکن پلان دهانی و خشکی دهان پایدار را بررسی کردند. آنها در این مطالعه، با ارائه پرسشنامه به 2 گروه آزمایش و کنترل که ازنظر سن و جنس با یکدیگر یکسان بودند، حس خشکی دهان 116 فرد مبتلا به لیکن پلان دهانی در گروه آزمایش و 348 فرد گروه کنترل را بررسی کردند. در این مطالعه، میان 2 گروه ازنظر آماری تفاوت معناداری وجود داشت. در گروه آزمایش، لیکن پلان دهانی میانگین امتیاز حس خشکی دهان برابر با 20/4 بود، درحالیکه در گروه کنترل، میانگین امتیاز 14/7 (0/001>P) بود. در این مطالعه٬ ارتباط بین لیکن پلان دهانی و حس خشکی دهان تأیید شد [16].
در سال 2014، آرتیکو و همکاران مطالعهای تحت عنوان شیوع گونههای کاندیدا، حس خشکی دهان و کاهش بزاق در لیکن پلان دهانی انجام دادند. این مطالعه بر روی 3 گروه انجام شد. گروه 1، شامل 38 بیمار مبتلا به لیکن پلان دهانی، گروه 2 شامل 28 بیمار مبتلا به ضایعات غیر لیکن پلان دهانی و گروه 3 شامل 32 فرد بدون ضایعات مخاط دهان بودند. باتوجهبه شیوع حس خشکی دهان و کاهش بزاق، اختلاف آماری قابلملاحظهای بین 3 گروه وجود نداشت. در مقایسه با بیماران مبتلا به لیکن پلان دهانی و غیر لیکن پلان دهانی٬ شیوع بالاتر کلونیزاسیون توسط گونههای کاندیدا در افراد سالم یافت شد. میزان جریان بزاقی پایین٬ فاکتوری برای کلونیزاسیون گونههای کاندیدا نبود. این مطالعه نشان داد حس خشکی دهان و هایپوسالیویشن با شیوع یکسان در افراد با یا بدون ضایعات دهان رخ میدهد و حضور ضایعات دهانی، کلونیزاسیون توسط گونههای کاندیدا را افزایش نمیدهد [17].
در سال ۲۰۱۶، آقاحسینی و همکاران مطالعهای با عنوان گیرندههای کولینرژیک موسکارینی در بزاق مبتلایان به لیکنپلان دهانی انجام دادند. در این مطالعه٬ ۴۰ بیمار مبتلا به لیکنپلان دهانی با گروه کنترل (۴۰ نفر) که ازنظر سن و جنس سازگار بودند، مورد مطالعه قرار گرفتند. 2 پرسشنامه مختلف در مورد وجود حس خشکی دهان و ارزیابی شدت آن از افراد مطالعه تهیه شد. میزان بزاق تحریکی و غیرتحریکی بیماران و گروه کنترل مقایسه شد. همچنین سطح گیرندههای موسکارینی M3 بزاقی توسط کیت الایزا در 2 گروه مقایسه شد. سطح متوسط رسپتور ام.۳ بزاق غیرتحریکی بیماران مبتلا به لیکنپلان دهانی ۲۵درصد و در افراد سالم ۳۴ درصد بود که رسپتور ام.۳ بزاق غیرتحریکی افراد مبتلا به لیکنپلان بهطور معناداری از گروه کنترل پایینتر بود. درجه حس خشکی دهان طبق پرسشنامهها در افراد مبتلا به لیکنپلان بهطور معناداری بالاتر از افراد کنترل بود. جریان بزاق غیرتحریکی افراد مبتلا ۵۸ درصد و در افراد سالم ۸۹ درصد و جریان بزاق تحریکی افراد مبتلا ۸۴ درصد و در افراد سالم 1/26 بود که در هر 2 مورد٬ بزاق تحریکی و غیرتحریکی اختلاف بین گروه بیماران و گروه سالم معنادار بود. در این مطالعه٬ گیرندههای رسپتور ام.۳ در بیماران مبتلا به لیکن پلان دهانی پایینتر بود و این بیماران از حس خشکی دهان و کاهش جریان بزاقی رنج میبردند [10].
در سال ۲۰۱۷، آقاحسینی و همکاران مطالعهای با عنوان موسین 5B در بزاق و سرم بیماران مبتلا به لیکنپلان دهانی انجام دادند. در این مطالعه که بر روی ۳۰ بیمار مبتلا به لیکنپلان دهانی و ۳۰ فرد سالم و سازگار ازنظر سن و جنس انجام شد، جریان بزاق تحریکی و غیرتحریکی و سطوح موسین 5B در بزاق تحریکی و غیرتحریکی و سرم، با استفاده از کیتهای الایزا ارزیابی شد. جریان بزاق تحریکی٬ تفاوت معناداری بین 2 گروه نداشت. جریان بزاق غیرتحریکی بهطور معناداری در گروه بیماران پایینتر بود، سطوح موسین 5B در بزاق غیرتحریکی بیماران بهطور معناداری پایینتر بود، درحالیکه در بزاق تحریکی بیماران٬ تفاوت معناداری نداشت. سطوح موسین 5B در سرم بیماران مبتلا به لیکنپلان٬ بهطور معناداری بالاتر بود. از علل خشکی دهان در مبتلایان به لیکن پلان دهانی، کاهش در میزان جریان بزاق و موسین 5B است که هم درمرطوب کردن و هم در لغزنده کردن مؤثر است [18].
در سال ۲۰۱۷، الجانابی و همکاران مطالعهای با عنوان خشکی دهان و کاهش عملکرد غدد بزاقی در بیماران مبتلا به لیکنپلان دهانی قبل و پس از درمان با کورتیکواستروئید موضعی انجام دادند. در این مطالعه٬ ۱۹ بیمار مبتلا به لیکنپلان دهانی با استفاده از مقیاس آنالوگ بصری و پرسشنامه ازنظر شدت حس خشکی دهان مورد ارزیابی قرار گرفتند و جریان بزاق تحریکی و غیرتحریکی، pH و ظرفیت بافری بزاق غیرتحریکی در آنان اندازهگیری شد. تمامی بیماران حس خشکی دهان را قبل از درمان گزارش کردند و ۷۹ درصد بهبودی قابلتوجه حس خشکی دهان پس از درمان داشتند، اما درمان کورتیکواستروئید موضعی همراه با اختلاف آماری معنادار در جریان بزاق تحریکی و غیرتحریکی نبود؛ همچنین pH و ظرفیت بافری بزاق غیرتحریکی٬ اختلاف آماری معناداری پس از درمان با کورتیکواستروئید موضعی نشان ندادند. این مطالعه نشان داد درمان مبتلایان به لیکن پلان دهانی با کورتیکواستروئید موضعی٬ سبب کاهش در حس خشکی دهان میشود [19].
در سال٬۲۰۱۷ لرسرن و همکاران مطالعهای تحت عنوان علایم دهانی و یافتههای بزاقی در بیماران لیکن پلان دهانی و ضایعات لیکنوئید دهانی و استوماتیت، مطالعهای انجام دادند که هر 3 نوع بیماری را همراه با حس خشکی دهان بررسی میکرد، اما آنها هیچ تغییری در میزان جریان بزاق پیدا نکردند. میزان SIgA در بزاق تحریکی و غیر تحریکی گروه بیماران بیشتر از گروه کنترل بود، اما میزان پروتئینهای بزاقی در بزاق غیرتحریکی بیماران کمتر و به عکس در بزاق تحریکیشان بیش از گروه کنترل بود. هر 3 بیماری لیکن پلان دهانی، OLL و استوماتیت ژنرالیزه همراه با حس خشکی دهان هستند، اما هیچیک همراه با تغییر در جریان بزاق نیستند [20].
بحث
لیکن پلان دهانی، بیماری التهابی مزمن و راجعه شایع و جزء بیماریهای خودایمنی با واسطه سلولهای T است که توسط ضایعات مخاطی دو طرفه متعدد با نمای کراتوتیک و یا آتروفیک اروزیو و ندرتا بولوز مشخص میشود [21]. نقش اتوایمیونیتی در پاتوژنز این بیماری، توسط بسیاری از ویژگیهای خودایمنی لیکن پلان دهانی ازجمله مزمن بودن، شروع در بزرگسالی، تمایل به زنان، همراهی با سایر بیماریهای اتوایمیون، کاهش فعالیت ایمونوساپرسیو و حضور کلونهای سلولهای T سایتوتوکسیک حمایت میشود [22].
حس خشکی دهان از این جهت اهمیت دارد که کاهش بزاق میتواند منتهی به سیالوزیس، ژنژیویت، از دست رفتن حس چشایی و سایر اختلالات حفره دهان شود. بزاق٬ ویژگیهای عملکردی متعددی ازجمله کمک به هضم، لوبریکیشن و حفظ حفره دهان، ظرفیت بافرینگ، ترمیم زخم و محافظت از تروماهای مکانیکی و شیمیایی دارد [23]. فاکتورهای ساختاری یا عملکردی، یا هر 2 ممکن است منتهی به دیسفانکشن غده بزاقی شود. اختلالات ساختاری غده بزاقی، شامل سندرم شوگرن، سارکوئیدوز، آسیب بعد از پرتوتابی، آنومالیهای تکاملی و دیابت ملیتوس هستند. وضعیتهای اضطرابی مزمن، دهیدراسیون و دارودرمانی از علل عملکردی حس خشکی دهان هستند. شرایطی که ممکن است همراه با حس خشکی دهان با منشأ ناشناخته باشد شامل اتیولوژی نوروپاتیک، تغییر ترکیب بزاق، سایز کوچکتر غده بزاقی و سایر بیماریها ازجمله لیکن پلان هستند [24].
مکانیسمهای درگیر در مهار پروسه ترشحی میتواند شامل موارد زیر باشد:
- قطع عصب غدهای،
- مهار آزادسازی نوروترانسمیتر توسط سایتوکاینها،
- افزایش تخریب استیلکولین توسط کولیناستراز،
- انسداد گیرنده موسکارینی استیل کولین M3،
- مسیریابی کلسیم تغییر یافته،
- انتقال آب ترنس سلولار [25].
بهداشت دهانی و کمیت و کیفیت بزاق، تأثیر چشمگیری در شرایط و کیفیت زندگی بیماران مبتلا به بیماریهای اتوایمیون ازجمله، لیکن پلان دهانی دارد. بزاق نقش آنتیباکتریال، آنتیوایرال و ضدقارچی دارد. علاوهبراین، اثرات مهمی در مرطوب نگه داشتن و لغزندگی مخاط دهان دارد [10]. روند ترمیم زخم در حفره دهان، سریعتر و با شکلگیری اسکار کمتر در مقایسه با سایر نواحی بدن اتفاق میافتد. حضور بزاق، فاکتور مهمی است که در روند ترمیم زخم اثر میگذارد. بزاق، محیط مرطوبی را فراهم میکند که عملکرد و بقای سلولهای التهابی موردنیاز برای ترمیم زخم را بهبود میبخشد [26]. همچنین بزاق در حفظ سلامت دندانها و PH نرمال دهان ضروری است. نقص در میزان جریان بزاق و کیفیت و ترکیب آن، سبب افزایش شیوع پوسیدگیهای دندانی، بیماریهای پریودنتال و افزایش ضایعات و زخمهای دهان میشود [10]. به نظر میرسد جریان بزاقی کاهشیافته در بیماران لیکن پلان دهانی، میتواند منجر به تأخیر در ترمیم زخمهای دهانی در این بیماران شود و ممکن است مسئول پایداری زخمها در این بیماران باشد [10]. در این مطالعه مروری، نشان داده شد شیوع خشکی دهان و کاهش میزان بزاق در مبتلایان به لیکن پلان دهانی، بهطور چشمگیری افزایش مییابد.
در مطالعهای که در سال 2017 انجام شد، میزان حس خشکی دهان در مبتلایان به لیکن پلان دهانی بهطور معناداری بیشتر از گروه افراد سالم بود، درصورتیکه بروز حس خشکی دهان در این افراد، مرتبط با کاهش جریان بزاق نبود. نتایج نشان داد حس خشکی دهان بدون کاهش در کمیت بزاق در مبتلایان به لیکن پلان دهانی ایجاد میشود. همچنین ارتباطی بین جنس و سن مبتلایان لیکن پلان دهانی و داروهایی مصرفیشان با خشکی دهان وجود نداشت و حس خشکی دهان میتواند به اختلالات موجود در سیستم اعصاب حسی، مرتبط با مکانیسم التهابی و اتوایمیون بیماری لیکن پلان دهانی مرتبط باشد. در این تحقیق، چند مکانیسم دیگر را جهت بروز حس خشکی دهان در بیماران لیکن پلان دهانی بیان کردند:
اولین مکانیسم بیانشده در این مطالعه، تغییر در کیفیت بزاق افراد مبتلا به لیکن پلان دهانی بود. در این بررسی، میزان کل پروتئینهای بزاقی و ایمونوگلوبولین ترشحی A در گروه لیکن پلان دهانی بیشتر از افراد گروه کنترل (سالم) بود، هرچند این اختلاف معنادار نشد.
مکانیسم دیگری که مطرح شد، ارتباط بیماری لیکن پلان دهان با اختلالات سایکولوژیک ازجمله اضطراب، افسردگی و اختلالات خواب است. در بیماران مبتلا به لیکن پلان دهانی، میزان کورتیزول بزاق، ایمونوگلوبولین ترشحیA و پروتئینهای بزاقی میتواند بهدلیل این اختلالات سایکولوژیک افزایش یابد که مسبب خشکی دهان در این گروه از بیماران است.
مکانیسم سومی که در این مطالعه به آن اشاره شد، ارتباط بین وقوع لیکن پلان و هیپوتیروئیدیسم است که احتمال دارد حس خشکی دهان در بیماران لیکن پلان دهانی بهدلیل همراهی با سایر بیماریهای اتوایمیون دیگر از جمله کمکاری تیروئید باشد [20].
در مجموع، علائم خشکی دهان و درد مخاطی، ممکن است بر تجربه بیماران از سلامت کلی٬ اثر منفی داشته باشد. خشکی دهان اغلب توسط هیپوفانکشن غده بزاقی ایجاد میشود٬ اما ممکن است حتی در حضور جریان بزاقی به ظاهر نرمال نیز رخ دهد که نشاندهنده این است که نه تنها کمیت بلکه کیفیت بزاق نیز ممکن است در راحتی دهان نقش داشته باشد. بنابراین، تغییرات در ترکیب بزاق ممکن است در چسبندگی و لغزندگی مخاط اثر داشته باشد [12].
در مطالعهای، کاهش قابلتوجه در میزان موسین 5B در مبتلایان به لیکن پلان دهانی را علت حس خشکی دهان در این گروه از بیماران ذکر کردند. موسین 5B و گلیکو٬ پروتئین مهمی در بزاق و حفره دهان است که نقش مهمی در ایجاد لغزندگی، مرطوبسازی و نرم نگه داشتن مخاط دهان دارد. موسین٬ همچنین سبب حفاظت از مخاط دهان، تسهیل عمل جویدن، هضم و صحبت کردن دارد. علاوهبراین موسین نقش آنتیمیکروبیال نیز دارد. موسین 5B عمدتاً توسط سلولهای آسینار سروزی در غدد بزاقی زیرزبانی و فرعی ترشح میشود. در جریان بزاق غیرتحریکی افراد مبتلا به لیکن پلان دهان٬ میزان ترشح موسین 5B کمتر از بزاق تحریکی است، زیرا عمده ترشح بزاق غیرتحریکی به عهده این غدد است. مکانیسمی که سبب کاهش میزان موسین 5B در بیماران لیکن پلان دهانی میشود، تغییر در سیگنالدهی و میزان سایتوکاینهای پیشالتهابی مانند1-IL، 6-IL وTNF آلفا است که به نوبه خود سبب تغییر بیان گلیکوپروتئینهای موسین میشود [18]. در مطالعهای نیز، کاهش قابلتوجه گیرندههای موسکارینیک ام.۳ ، درکاسته شدن میزان جریان بزاق تحریکی و غیرتحریکی و بروز خشکی دهان در مبتلایان لیکن پلان دهانی مؤثر بوده است [10].
کولگوهان و همکاران در مطالعه خود، تغییر در ویژگیهای سطحی مخاط دهان بهعلت وجود التهاب، سبب ایجاد حس خشکی دهان در مبتلایان به لیکن پلان دهانی بیان کردند و مشخص شد که وجود التهاب در مخاط دهان، حتی با وجود میزان جریان بزاق نرمال، سبب حس خشکی دهان در این بیماران میشود [16]. مطالعه الجنابی و همکاران نیز در بیماران مبتلا به لیکن پلان دهان، ارتباط حس خشکی دهان و آسیب مخاط دهان بهدلیل فرایند التهابی را نشان میدهد. در این مطالعه، بهدنبال استفاده از کورتیکواستروئید موضعی، در بیماران لیکن پلان دهانی سرکوب و کاهش التهاب مخاط دهان به بهبود قابلتوجه علایم خشکی دهان انجامید. این نتیجه با بهبودی قابلتوجه در خشکی دهان افراد مبتلا به لیکن پلان نوع شدید بهویژه انواع اروزیو و اولسراتیو نسبت به نوع رتیکولر بیشتر حمایت میشود. نقص در تعادل مایع در دهان نیز مکانیسم دیگری است که در رابطه با خشکی دهان در این مطالعه پیشنهاد شد.
نتیجهگیری
بزاق٬ بهصورت لایه نازکی سراسر مخاط دهان را میپوشاند که ضخامت این لایه میتواند باتوجهبه هر ناحیه از دهان بین 72 تا 100 میکرون متغیر باشد. پایداری و ثبات این میزان از بزاق در مخاط دهان٬ بهدلیل تعادل بین ترشح غدد بزاقی و از دست رفتن مایع حین بلع و جذب از طریق اپیتلیوم مخاط و تبخیر است. در افرادی که مبتلا به حس خشکی دهان هستند، میزان ضخامت این لایه بزاقی کاهش مییابد و این کاهش٬ الزاماً مربوط به کاهش کمّی بزاق نیست. التهاب مزمن مخاطی در بیماری لیکن پلان دهانی میتواند سبب به مخاطره انداختن یکپارچگی و عملکرد مخاط دهان شود. این اتفاق بهویژه ازطریق اثر بر جذب و ترشح نرمال مایع و الکترولیتهای مخاطی که در وقوع خشکی دهان مؤثر هستند، به وجود میآید. از دست رفتن اپیتلیوم مخاط دهان که در زخم مشاهده میشود، سبب ایجاد اختلال در تشکیل پلیکل مخاط دهان میشود. این در حالی است که این ماده در لغزندگی مخاط دهان نقش مهمی را ایفا میکند. حرارت مرتبط با واکنش التهابی٬ میتواند سبب تقویت تبخیر سطحی مخاط و نهایتاً حس خشکی دهان شود [19].
بنابراین بیماران مبتلا به لیکن پلان دهانی٬ درجاتی از خشکی دهان را تجربه میکنند که با حس خشکی دهان مربوط به اختلالات موجود در سیستم اعصاب حسی مرتبط با مکانیسم التهابی و خودایمنی، تغییرترکیبات بزاق و تغییر جریان بزاق در این بیماران مرتبط است. کنترل خشکی دهان در بیماران مبتلا به لیکن پلان دهان٬ باید مورد توجه پزشک قرار گیرد و تا حد زیادی میتواند به بهبود علائم این بیماران کمک کند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مقاله حاصل یک مطالعه مروری است و دارای هیچ نمونه انسانی یا حیوانی نبوده است و کد اخلاق برای آن قابل تعریف نیست.
حامی مالی
این پژوهش هیچگونه کمک مالی از سازمانیهای دولتی، خصوصی و غیرانتفاعی دریافت نکرده است.
مشارکت نویسندگان
مفهومسازی: آقاحسینی و موسوی؛ تحقیق و بررسی: آقاحسینی، براتی و الهام؛ ویراستاری و نهاییسازی نوشته: آقاحسینی، براتی، الهام و موسوی.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
References