

نوع مقاله : مقاله پژوهشی
نویسندگان
1 گروه شیمی دارویی، دانشکده داروسازی، دانشگاه علو م پزشکی جندی شاپور اهواز، اهواز، ایران
2 کمیته تحقیقات دانشجویی، دانشگاه علوم پزشکی جندی شاپور اهواز، اهواز، ایران
چکیده
کلیدواژهها
Introduction
The spread of resistance to antimicrobial agents is currently considered as one of the major global health problems. Treatment-resistant hospital-acquired infections can cause an increase in mortality rate and treatment costs. Currently, Staphylococcus aureus, enterococci, Pseudomonas aeruginosa, Escherichia coli and Candida albicans are the main causes of hospital-acquired infections. Due to the prevalence of fungal and bacterial infections in recent years, efforts are being made to design and synthesize novel compounds that are effective against these organisms. Evaluation of the antimicrobial activity of the diphenyl pyridine phosphine gold(I)-thiolate compounds was first done by Robert Koch at the end of the 19th century, who showed that potassium dicyanidoaurate (I) with formula K[Au(CN)2], had antimicrobial activity against Mycobacterium tuberculosis. In the mid-20th century, gold(I) complexes were used clinically as anti-inflammatory agents for the treatment of various rheumatic diseases, including psoriatic arthritis, juvenile arthritis, and palindromic rheumatism. Recent studies have shown that gold(I) compounds are promising candidates for making antimicrobial drugs. The interest in gold-based drugs is increasing. Inhibition of the thioredoxin reductase (TrxR) enzyme is the most important biological target for antimicrobial gold(I) compounds.
Methods
In this study, five diphenyl pyridine phosphine gold(I)-thiolate compounds underwent biological evaluation. All compounds contained the diphenyl-pyridinephosphine ligand. They were attached to chlorine in the Au1 complex and to thiolate ligands (2-mercaptopyridine, 2-mercaptopyrimidine, 2-mercaptobenzothiazole and 2-mercapto-dihydro-thiazole) in Au2- to Au5 complexes. Bacteria and yeasts were stored as glycerol stocks at -80 °C. Before each experimental, they were gently placed on Mueller-Hinton plates. Colonies of new prepared plates were incubated overnight at 37 °C in 5 mL of media. The overnight culture medium was diluted to OD600<0.01 in 2 mL of new prepared media in sterile culture tubes. The compounds (auranofin and synthesized gold compounds) were dissolved in dimethyl sulfoxide (DMSO) and a concentration of 1 mg/mL was prepared from them. Then, they were diluted at specific concentrations in cell culture tubes. Control tubes for each cell type were incubated with an equivalent concentration of DMSO. The 200-μL cultures were transferred to a 96-well plate. The plates were incubated at the appropriate temperature and were shaken in a microplate reader (ELx808, Biotek Co.). Growth measurements (OD600) were performed automatically every hour for 24 hours. The minimum inhibitory concentration (MIC) was determined as the concentration at which there was a negligible increase in the OD600 value from the initial reading after 24 hours.
Molecular docking studies of these compounds were performed on TrxR enzyme using AutoDock 4.2. In this regard, the best X-ray crystallographic structure of a TxrR enzyme with PDB code of 4CBQ was extracted from the protein data bank. The ranking was done only based on the ligand-receptor binding free energy data from the final AutoDock docking log file (dlg). MOE 2014 and ADT software were used to analyze the interaction of compounds with the receptor.
Result
The results from analyzing the antibacterial effects of the study compounds on standard and clinical samples of Gram-positive and Gram-negative bacteria are shown in Table 1. The antibacterial activity of all compounds were compared with the antibacterial activities of auranofin (an anti-rheumatoid gold-containing drug) and ciprofloxacin. These compounds had the MIC values ranged from 3 to 100 μg/mL. The most active compound (Au3) had an MIC of 3.89, 3.15, 4.36, 5.44, 6.13, and 8.37 μg/mL against P. aeruginosa, E. coli, S. aureus, B. subtilis, C. albicans and S. cerevisiae, respectively. Molecular docking was performed to find out their binding site and binding mode to the TrxR. In evaluating the effects of antifungal and yeast activity of gold complexes on C. albicans and S. cerevisiae, the highest antifungal activity observed was related to the Au3 compound.

The structure-activity relationship of gold(I) compounds showed that the absence of thiolate ligand significantly reduced the antimicrobial activity. The presence of aromatic thiolate ligand significantly increased the antimicrobial activity.
The binding of these compounds to the amino acids of the active site of the TrxR enzyme was also investigated. As shown in Figure 1, the Au2 compound formed a weak hydrogen bonding with amino acid Thr269 through sulfur attached to its pyridine ring. The binding of gold atom to amino acid Cys286, which is one of the most important binding compounds of TrxR inhibitors, was also observed.

Discussion
In this study, the antimicrobial effects of five diphenyl pyridine phosphine gold(I)-thiolate compounds on two types of gram-negative bacteria (P. aeruginosa and E. coli), two types of gram-positive bacteria (S. aureus and B. subtilis), one type of fungus (C. albicans) and one type of yeast (S. cerevisiae) were evaluated. These compounds showed good antimicrobial activity and had high potential in inhibiting the growth of microbial cells. The best compound complex was Au3. These compounds act much better especially on gram-negative and yeast strains compared to auranofin as antirheumatic drug. These compounds, especially the Au3, are potentially valuable for drug development and can be a promising antimicrobial agent.
Ethical Considerations
Compliance with ethical guidelines
The present article is a part of Salar Nosrati's professional doctorate thesis in the field of general pharmacy, Department of Medicinal Chemistry, Faculty of Pharmacy, Ahvaz Jundishapor University of Medical Sciences, which was approved by the Research Vice-Chancellor of Ahvaz Jundishapour University of Medical Sciences with code B-9606. The ethics code of this work is IR.AJUMS.REC.1396.77.
Funding
This work was supported by the Ahvaz Jundishapur University of Medical Sciences.
Authors' contributions
Carrying out practical work and biological tests: Salar Nosrati and writing the article and data analysis: Masoud Faridunnejad.
Conflicts of interest
The authors declared no conflict of interest.
Acknowledgements
The authors express their gratitude to Ahvaz Jundishapur University of Medical Sciences, who provided the funds for this work, and the Department of Medicinal Chemistry, Faculty of Pharmacy, who provided the necessary facilities.
مقدمه
در کنار کاربردهای بسیار طلا در دندانپزشکی، سیستمهای پولی، جواهرات و الکترونیک، این فلز و کمپلکسهای آن در علم طب در طول تاریخ تمدن برای درمان طیف گستردهای از بیماریها استفاده شده است.کمپلکسهای طلا٬ نقش دارویی مهمی را از زمان باستان ایفا میکنند و کاربرد آنها به بیش از دو هزار سال پیش بازمیگردد [1]. بهرهگیری از خاصیت ضدمیکروبی کمپلکسهای طلا٬ از کار رابرت کخ در پایان قرن 19 نشأت میگیرد. کسی که نشان داد پتاسیم دیسیانیدو آورات (I)، [2(K[Au(CN، در برابر مایکوباکتریوم توبرکلوزیس عامل بیماری سل، فعالیت ضدمیکروبی دارد. در اواسط قرن بیستم، از کمپلکسهای طلا1 بهعنوان عوامل ضدالتهاب مفصل برای درمان روماتیسم مفصلی و انواع بیماریهای روماتیسمی ازجمله ورم مفاصل پسوریاتیک، التهاب مفصل نوجوانان، روماتیسم پالیندرومیک و لوپوس اریتماتوی قرصمانند استفاده بالینی شد [2]. پس از آن، تعداد زیادی از کمپلکسهای طلا1 و طلا 3 برای استفاده بالقوه از آنها در درمان سرطان، آسم، بهعنوان عوامل ضد ایدز و ضدمیکروبی در برابر طیف گستردهای از باکتریها، قارچها و انگلها ارزیابی شدند [3- 6].
شیوع مقاومت به عوامل ضدمیکروبی، در حال حاضر بهعنوان یکی از معضلات بزرگ بهداشت جهانی محسوب میشود. عفونتهای بیمارستانی مقاوم به درمان، سبب افزایش میزان مرگومیر و هزینههای درمانی میشوند[٬۷ ۸]. در حال حاضر استافیلوکوک اورئوس، انتروکوکها، پسودوموناس آئروژینوزا، اشرشیاکلی و کاندیدا آلبیکنس، بهعنوان عوامل اصلی عفونتهای بیمارستانی مطرح میشوند [٬۹ ۱۰]. باتوجهبه شیوع عفونتهای قارچی و باکتریایی در سالهای اخیر، سعی بر این است که ترکیبات جدید مؤثر بر این ارگانیسمها طراحی و سنتز شوند [٬۱۱ ۱۲].
در این طرح، ارزیابی فعالیت ضدمیکروبی ترکیبات دیفنیل پیریدین فسفین طلا1-تیولات که اخیراً سنتز شدهاند [13] و با استفاده از روشهای NMR، تحلیل عنصری (CHN) و پراش پرتوی ایکس کاملاً تعیین ساختار شدهاند، روی دو گونه باکتری گرم منفی (پسودوموناس آئروژینوزا و اشرشیاکلی)، دو گونه باکتری گرم مثبت (استافیلوکوک اورئوس و باسیلوس سوبتیلیس)، یک گونه قارچ (کاندیدا آلبیکنس) و یک گونه مخمر (ساکارومایسس سرویزیه) مورد ارزیابی قرار میگیرد و تلاش بر این است که درنهایت منجر به ارائه ترکیبات جدید با خاصیت ضدمیکروبی شود. ازآنجاییکه مکانیسم اصلی ترکیبات طلای ضدمیکروبی ازطریق مهار آنزیم تیوردوکسین ردوکتاز است [14]، بنابراین برهمکنش ترکیبات مورد بررسی با این آنزیم در فاز مولکولار مدلینگ بررسی شد. برای بررسی مکانیسم عمل ترکیبات موردمطالعه، داکینگ مولکولی آنها در جایگاه فعال آنزیم تیوردوکسینردوکتاز بررسی میشود و نحوه و چگونگی اتصال آنها به این آنزیم کاملاً مورد بررسی قرار میگیرد و درنهایت رابطه ساختار فعالیت آنها بررسی میشود.
روش بررسی
در این مطالعه، 5 کمپلکس طلا1 (تصویر شماره 1) برای ارزیابی بیولوژیک بررسی شدند [13]. تمامی کمپلکسها طلای1 است که از یکسو همگی در بردارنده لیگاند دیفنیل پیریدین فسفین هستند. از سوی دیگر، طلای1 متصل به کلر در کمپلکس Au1 و متصل به لیگاندهای تیولاتی در کمپلکسهای Au2-Au4 است. لیگاند تیولاتی بهترتیب 2- مرکاپتوپیریدین، 2-مرکاپتوپیریمیدین، 2-مرکاپتوبنزوتیازول و 2-مرکاپتودی هیدروتیازول در کمپلکسهای Au2 تا Au5 است (تصویر شماره 1).

روش تعیین حداقل غلظت مهارکنندگی برای ترکیبات طلا1
باکتریها و مخمرها بهصورت استوکهای گلیسرول در دمای °C80- نگهداری شدند و قبل از هر مجموعه آزمایشی به آرامی بر روی پلیتهای Mueller–Hinton یا YEPD قرار داده میشدند. کلونیهای پلیتهای تازهآمادهشده در 5mL از مدیا (tryptic soy broth برای پسودوموناس آئروژینوز و اشرشیاکلی و استافیلوکوک اورئوس و YPD broth برای مخمر ساکارومایسس سرویزیه انکوبه شدند و بهمدت شب تا صبح در دمای °C73 (در خصوص مخمر ساکارومایسس سرویزیه دمای °C03) رشد داده شدند. محیط کشت شبانهروز به 01/OD600<0 Thermo Spectronic, Genesys8) spectrophotometer) در 2mL از مدیای تازهتهیهشده در تیوبهای کشت استریل رقیق شدند. ترکیبات (auranofin و کمپلکسهای سنتزی طلا) در DMSO حل شدند و غلظت 1میکروگرم بر میکرولیتر از آنها تهیه شدند. سپس در غلظتهای مشخص درون تیوبهای کشت سلولی رقیق شدند. تیوبهای کنترل برای هر نوع سلول با غلظت اکی والان DMSO تنها انکوبه شدند. کشتها به حجم 200 میکرولیتر درون پلیت 96 تایی منتقل شدند. پلیتها در دمای مناسب انکوبه شدند و در Biotek ELx808 plate reader تکان داده شدند. اندازهگیریهای رشد (OD600) به مدت یک روز در هریک ساعت ثبت شد. در حداقل غلظت مهارکنندگی، غلظتی تعیین شد که در آن افزایش ناچیزی در مقدار OD600 از خواندن آغازین بعد از 24 ساعت وجود داشته باشد [15]. هر کدام از نمونهها بهصورت مستقل با 3 بار تکرار تست شدند.
داکینگ مولکولی
مطالعات داکینگ مولکولی این ترکیبات با آنزیم تیوردوکسینردوکتاز توسط نسخه 4،2 نرمافزاراتوداک انجام شد. بهمنظور انجام مطالعات داکینگ، بهترین ساختار کریستالوگرافی اشعه ایکس مربوط به آنزیم تیوردوکسینردوکتاز باPDB کد 4CBQ بانک دادههای پروتئینی استخراج شدند. با استفاده از نرمافزار modelface تمام تصحیحهای اسید آمینهای یا بازهای DNA انجام میشود و لیگاند کوکریستاله و آب حذف میشوند [16]. سپس با استفاده از نرمافزار ADT اتمهای هیدروژن غیرقطبی در اتم کربن مربوطه ادغام شده و بارالکتریکی کُلمن و پارامترهای حلالپوشی ماکرومولکول محاسبه و در نهایت فایل ماکرومولکول بهصورت pdbqt ذخیره شد. از سوی دیگر، ساختار 2 بعدی کمپلکسهای دیفنیل پیریدین فسفین طلا1-تیولات با استفاده از نرمافزار ChemBioDraw 2D ترسیم شد. سپس به محیط نرمافزار گرافیکی Hyperchem 8 منتقل شد. در این حالت، بهینهسازی کانفورماسیون لیگاند ازنظر انرژی با روش مولکولار مکانیک انجام شد. در ادامه با برنامه Gaussian 09 و تحت روش Hartree-Fock بهینه شدن انرژی انجام شد. این فایل به صورت pdb ذخیره شد. پس از بهینهسازی انرژی لیگاند، بارالکتریکی گَستیگِر، بارهای الکتریکی اتم که بهصورت تجربی محاسبه میشود و تعداد درجات آزادی زوایای پیچشی لیگاند با استفاده از نرمافزار ADT محاسبه شد. درنهایت فایل لیگاند به صورت pdbqt ذخیره شد.
پس از آمادهسازی فایلهای ورودی موردنیاز داکینگ (ماکرومولکول، لیگاند و نقشه اتصال)، مطالعات داکینگ بهمنظور مدلسازی برهمکنشهای لیگاند-DNA و آنزیم، با استفاده از الگوریتمی تحت عنوان ژنتیک لامارکین انجام شد. در مطالعه حاضر، بر اساس حجم مولکولی لیگاندهای طراحیشده، شبکهای با ابعاد 40×40×40 آنگستروم برای 4CBQ در راستای محورهای 3 گانه مختصات و فاصله نقاط شبکه 0/375 آنگستروم (یکچهارم طول پیوند ساده کربن-کربن) که دربرگیرنده جایگاه فعال آنزیم بود، در نظر گرفته شد. مختصات مرکز جعبه برای رسپتور4CBQ عبارتاند از (4/92-، 7/11-، 22/25-). محاسبه اتوگرید با پارامترهای تخصیصیافته منجر به تولید فایل نقشه اتمهای مختلف میشود. بهمنظور اجتناب از تکرار در محاسبه اتوگرید برای هریک از لیگاندهای بانک ساختاری، نقشه تمام اتمهایی که توسط نرمافزار اتوکد پوشش داده میشود، محاسبه و از این فایلها در تمام محاسبات استفاده شد. در مرحله بعد، باید فایلهای اجرایی برنامه تعریفشده و همچنین پارامترهای مختلف داکینگ نیز تنظیم شود. این اطلاعات بهصورت فایل خروجی پارامتر داکینگ (dpf) و با نرمافزار ADT ذخیره میشوند. ازآنجاکه ترکیبات موردمطالعه فلزدار هستند، لازم است که در خروجیهای داکینگ (gpf و dpf) پارامتر فلز طلا در فایلهای مذکور کپی شود [17]. رتبهبندی تنها براساس دادههای انرژی آزاد اتصال لیگاند-رسپتور از فایل خروجی نهایی داکینگ (dlg) انجام شده است. جهت نشان دادن نحوه برهمکنش ترکیبات با گیرنده از نسخه 2014نرمافزارهای MOE [18] و ADT استفاده شد. دراین مطالعه، از یک روش متداول برای معتبرسازی محاسبات داکینگ استفاده شده است. در این روش، اختلاف مجذور مربع میانگین مختصات اتمهای مربوط به کنفورماسیون لیگاند اصلی مستخرج از ساختارکریستالوگرافی و برترین کانفورماسیون محاسبهشده این لیگاند، توسط محاسبات داکینگ بهعنوان معیاری از صحت بهترین کانفورمر پیشبینیشده توسط نرمافزار استفاده شده است.
یافتهها
ارزیابی فعالیت ضدمیکروبی
اثر ضدباکتریایی ترکیبات موردبررسی بر روی نمونههای استاندارد و بالینی باکتریهای گرم مثبت و منفی در جدول شماره 1 بهصورت (میانگین±انحرافمعیار حداقل غلظت مهاری/میکروگرم بر میلیلیتر) نشان داده شده است. فعالیت ضدباکتریایی تمامی ترکیبات با فعالیت ضدباکتریایی داروی ضدروماتوئیدی دارای اتم طلا در ساختار خود و همچنین آنتیبیوتیک سیپروفلوکساسین مقایسه شده است.

اثر ضد قارچ و مخمری ترکیبات موردبررسی بر روی نمونههای استاندارد و بالینی قارچ و مخمر موردبررسی در جدول شماره 2 بهصورت (میانگین±انحرافمعیار حداقل غلظت مهاری/میکروگرم بر میلیلیتر) نشان داده شده است. فعالیت ضدقارچ و مخمری تمامی ترکیبات با فعالیت ضدباکتریایی داروی اورانوفین مقایسه شده است.

داکینگ مولکولی
کمپلکسهای موردمطالعه بر روی جایگاه فعال آنزیم تیوردوکسینردوکتاز داک شدند. در این مرحله، ترکیبات بر اساس امتیاز تخصیصیافته رتبهبندی شدند. این رتبهبندی، تنها براساس دادههای انرژی آزاد اتصال لیگاند-رسپتور انجام شده است. همانطور که در جدول شماره 3 مشاهده میشود ترکیب Au3 دارای بهترین (منفیترین) انرژی اتصال به آنزیم تیوردوکسین ردوکتاز است. این ترکیب، بهدلیل داشتن حلقه پیریمیدین در ساختار خود نسبت به سایر ترکیبات در اتصال به این آنزیم بهتر عمل کرده است و با انرژی اتصال 6/88- کیلوکالری برمول به این آنزیم متصل میشود. در مقایسه فعالیت ضدمیکروبی این ترکیبات، ترکیب Au3 فعالیت ضدمیکروبی بهتر و قویتری نسبت به سایرین از خود نشان میدهد. نتایج فعالیت بیولوژیک حاکی از آن است که بخشی از بهتر بودن نتایج طلای 3 در قیاس با بقیه ترکیبات به اتصال بهتر آن به آنزیم تیوردوکسین ردوکتاز که از اهداف اصلی کمپلکسهای طلا است، میباشد.

ساختار کریستالی تیوردوکسین ردوکتاز با داروی اورانوفین متصل به Cys286
بعد از مشخص شدن جایگاه هر ترکیب در رتبهبندی داکینگ، فاکتور مهمی که مورد بررسی قرار گرفت نحوه برهمکنش ترکیبات با اسیدهای آمینه کلیدی جایگاه فعال آنزیم تیوردوکسینردوکتاز است. در حین فرایند بررسی نتایج داکینگ ترکیبات با رسپتور، تنها نمیتوان با تکیه بر دادههای کمی، داکینگ غربالگری را انجام داد. نکته تعیینکننده در این مرحله ارزیابی نحوه برهمکنش برترین کانفورمر پیشبینیشده توسط داکینگ با جایگاه فعال رسپتور است. چه بسا لیگاندی انرژی آزاد پیوند شدن بزرگ (منفی) داشته باشد، اما به موقعیتی به غیر از جایگاه فعال آنزیم متصل شود و یا حتی با وجود اتصال به جایگاه فعال٬ برهمکنشهای کلیدی با اسیدهای آمینهای را که در مدلهای فارماکوفوری ارائه شدهاند، نداشته باشد.
همانطور که در تصویر شماره 2 نشان داده میشود، اتصال این ترکیبات با اسیدهای آمینه جایگاه فعال آنزیم تیوردوکسینردوکتاز نیز مورد بررسی قرار گرفته است. ترکیب Au2 از طریق سولفور متصل به حلقه پیریدینی خود با اسید آمینه Thr269 پیوند هیدروژنی ضعیفی برقرار کرده است. اتصال اتم طلا به اسیدآمینه Cys286-که از مهمترین اتصالات ترکیبات مهارکننده تیوردوکسینردوکتاز است- نیز دیده میشود. این ترکیب، از طریق گروه فسفر خود با اسیدآمینه Cys286 پیوند برقرار کرده است.

نحوه برهمکنش ترکیب Au3 نیز با آنزیم تیوردوکسینردوکتاز بررسی شد (تصویر شماره ۳). این ترکیب، از طریق سولفور متصل به حلقه پیریمیدینی و همچنین از طریق نیتروژن حلقه پیریدینی متصل به فسفر با اسید آمینه Thr269 پیوند هیدروژنی برقرار کرده است. مهمترین اتصال این ترکیب که باید دیده شود، اتصال اتم طلا به اسیدآمینه Cys286 است. همانطورکه مشخص است این نوع برهمکنش دیده میشود. این ترکیب، ازطریق گروه فسفر خود نیز با اسیدآمینه Cys286 پیوند برقرار کرده است. بنابراین در فاز مولکولارمدلینگ اثر مهاری این ترکیبات بر آنزیم تیوردوکسینردوکتاز قابل اثبات است. محققان پژوهش حاضر٬ اثربخشی این ترکیبات بر آنزیم تیوردوکسین ردوکتاز میتوکندریایی و سیتوزولی را بهصورت آزمایشگاهی اثبات کردهاند [13] که در ادامه نحوه و چگونگی اتصال به آنزیم مورد ارزیابی قرار میگیرد.

بحث
همانطور که در جدول شماره 1 ارائه شده است، در ارزیابی اثرهای فعالیت ضدباکتریایی کمپلکسهای طلا بر روی باکتریهای گرم منفی پسودوموناس آئروژینوزا و اشرشیاکلی بیشترین فعالیت ضد باکتریایی مشاهدهشده در بین ترکیبات مجموعه مربوط به ترکیبات Au3و Au4 است. این 2 ترکیب، بهترتیب دارای حداقل غلظت مهاری برابر با 3/89 میکروگرم بر میلیلیتر و 4/12 میکروگرم بر میلیلیتر بر روی پسودوموناس آئروژینوزو دارای حداقل غلظت مهاری برابر با 3/15 میکروگرم بر میلیلیتر و 4/54 میکروگرم بر میلیلیتر بر روی اشرشیاکلی هستند. تحلیل آماری بهروش تحلیل واریانس یکطرفه شان میدهد اختلاف معناداری بین این 2 ترکیب وجود ندارد. ترکیب Au2 نیز فعالیت ضدباکتریایی مناسبی از خود نشان میدهد. این ترکیب دارای حداقل غلظت مهاری برابر با 5/12 میکروگرم بر میلیلیتر و 6/32 میکروگرم بر میلیلیتر بر روی باکتریهای گرم منفی اشرشیاکلی و پسودوموناس آئروژینوزا است. ضعیفترین ترکیب از میان ترکیبات مجموعه Au1 است. این ترکیب در غلظتهای 42/65 میکروگرم بر میلیلیتر و 54/78 میکروگرم بر میلیلیتر باعث مهار کامل رشد باکتریهای گرم منفی اشرشیاکلی و پسودوموناس آئروژینوزا میشود. تمامی ترکیبات مجموعه، اثر ضدباکتریایی قویتری نسبت به داروی اورانوفین بر باکتریهای گرم منفی نشان میدهند و تحلیل آماری واریانس یکطرفه نشان داد که این اختلاف معنادار است. حداقل غلظت مهاری۱۰۰< اورانوفین روی باکتریهای گرم منفی است. از سویدیگر، ترکیبات معرفیشده در این مطالعه در مقایسه با آنتیبیوتیک سیپروفلوکساسین فعالیت ضعیفتری نشان دادند.
همانطور که در جدول شماره 1 آورده شده است، در ارزیابی اثرات فعالیت ضدباکتریایی کمپلکسهای طلا بر روی باکتریهای گرم مثبت استافیلوکوک اورئوس و باسیلوس سوبتیلیس بیشترین فعالیت ضدباکتریایی مشاهدهشده در بین ترکیبات مجموعه مربوط به ترکیبات Au3 و Au2 است. این 2 ترکیب بهترتیب دارای حداقل غلظت مهاری برابر با 4/36 میکروگرم بر میلیلیتر و 18/27 میکروگرم بر میلیلیتر بر روی استافیلوکوک اورئوس و دارای حداقل غلظت مهاریبرابر با 5/44 میکروگرم بر میلیلیتر و 6/01 میکروگرم بر میلیلیتر بر روی باسیلوس سوبتیلیس هستند. ضعیفترین ترکیب از میان ترکیبات مجموعه Au1 است. این ترکیب دارای حداقل غلظت مهاری برابر با 52/48 میکروگرم بر میلیلیتر و 65/18 میکروگرم بر میلیلیتر بر روی باکتریهای گرم مثبت باسیلوس سوبتیلیس و استافیلوکوک اورئوس است. این درحالی است که تمامی ترکیبات مجموعه، اثر ضدباکتریایی کمتری نسبت به داروی اورانوفین روی باکتریهای گرم مثبت نشان میدهند. اورانوفین دارای<1 حداقل غلظت مهاری روی باکتریهای گرم منفی است. از سویدیگر، آنتیبیوتیک سیپروفلوکساسین فعالیت بسیار قدرتمندتری نسبت به ترکیبات مجموعه از خود نشان میدهد.
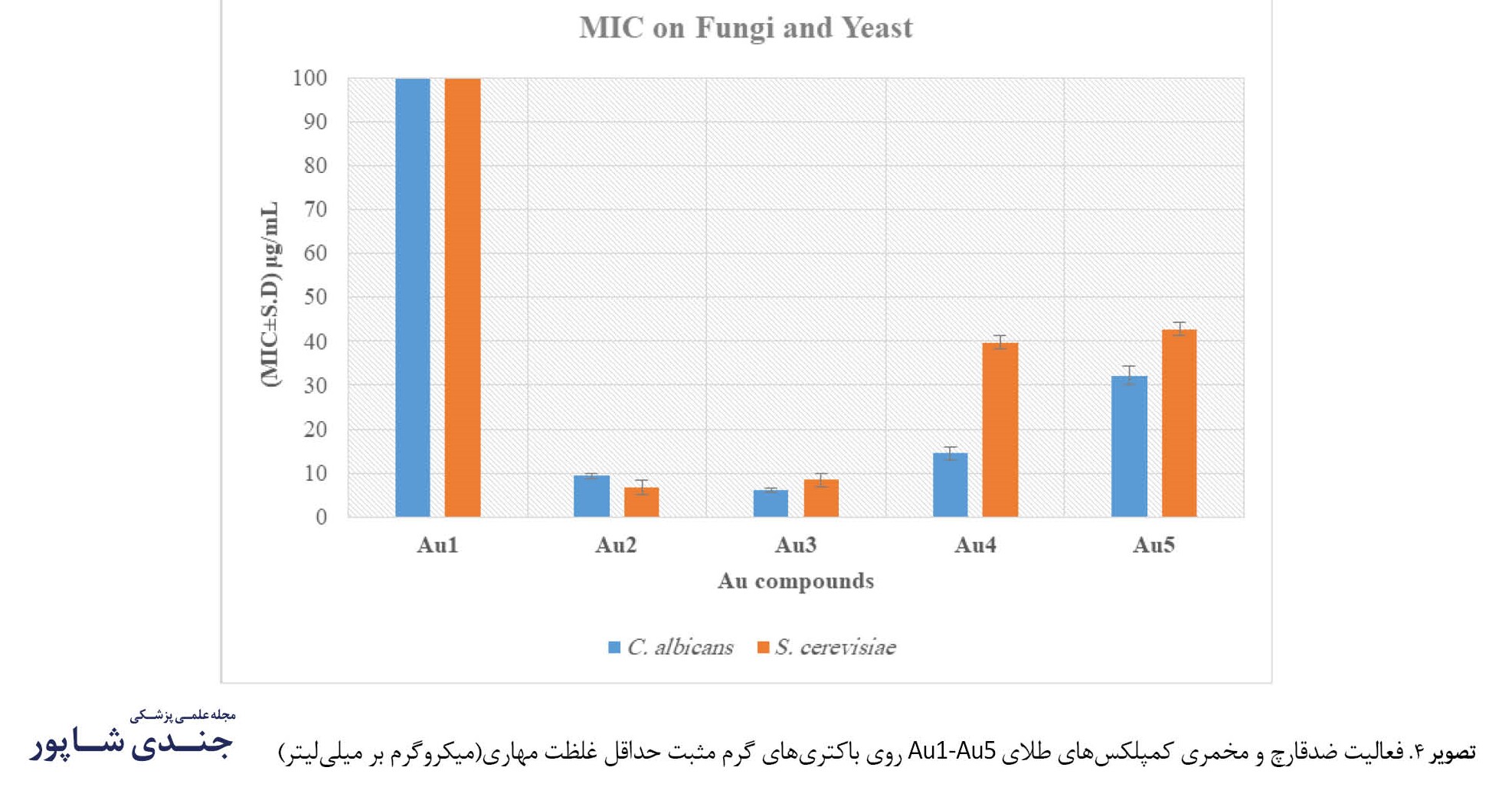
همانطور که در جدول شماره 2 و تصویر شماره 4 ارائه شده است، در ارزیابی اثرهای فعالیت ضدقارچ و مخمری کمپلکسهای طلا بر روی قارچ کاندیدا آلبیکنس و مخمر ساکارومایسس سرویزیه، بیشترین فعالیت ضدقارچی مشاهدهشده در بین ترکیبات مجموعه مربوط به ترکیب Au3و بیشترین فعالیت ضدمخمری مشاهدهشده در بین ترکیبات مجموعه مربوط به ترکیباتAu2 است. ترکیب Au3 بهترتیب دارای حداقل غلظت مهاری برابر با 6/13 میکروگرم بر میلیلیتر و 8/37 میکروگرم بر میلیلیتر بر روی کاندیدا آلبیکنس و ساکارومایسس سرویزیه است. درحالیکه ترکیب Au2 بهترتیب دارای حداقل غلظت مهاری برابر با 9/30 میکروگرم بر میلیلیتر و 6/78 میکروگرم بر میلیلیتر بر روی کاندیدا آلبیکنس و ساکارومایسس سرویزیه است. ضعیفترین ترکیب از میان ترکیبات مجموعه Au1 است. این ترکیب دارای حداقل غلظت مهاری 100<بر روی قارچ کاندیدا آلبیکنس و مخمر ساکارومایسس سرویزیه است. این درحالیست که تمامی ترکیبات مجموعه٬ اثر ضدقارچی کمتری نسبت به داروی اورانوفین نشان میدهند. اورانوفین دارای <1حداقل غلظت مهاری بر روی قارچ کاندیدا آلبیکنس است. ازسویدیگر، تمامی ترکیبات مجموعه بهجز کمپلکس Au1 اثر ضدمخمری قویتری نسبت به داروی اورانوفین بر روی مخمر ساکارومایسس سرویزیه نشان میدهند.
باتوجهبه نتایج بیولوژیک بهدستآمده، در ادامه رابطه ساختار-فعالیت کمپلکسهای ضدمیکروبی طلا بررسی نشان داد که در نگاه اول عدم حضور لیگاند تیولاتی فعالیت ضدمیکروبی را بهطور چشمگیری کاهش میدهد. همانطور که بیان شد، ترکیب Au1 که بهجای لیگاند تیولاتی دارای اتم کلر در ساختار خود است، ضعیفترین نتایج ضدمیکروبی را از خود نشان میدهد. وجود لیگاند تیولاتی آروماتیک فعالیت ضدمیکروبی را افزایش میدهد. در میان ترکیبات دارای لیگاند تیولاتی، کمپلکس Au4 ضعیفترین نتایج ضدمیکروبی را نشان میدهد. این ترکیب دارای لیگاند تیولاتی دیهیدروتیازول غیرآروماتیک است. قویترین ترکیب مجموعه بر گونههای گرم مثبت، گرم منفی و قارچ یعنی ترکیب Au3 دارای لیگاند تیولاتی پیریمیدین در ساختار خود است که به نظر میآید وجود 2 گروه نیتروژن در این حلقه، باعث افزایش فعالیت ضدمیکروبی آن نسبت به ترکیب Au2 -که لیگاند تیولاتی پیریدینی دارد- شده است. نتایج داکینگ مولکولی نیز نشان میدهد که این ترکیب، بهترین اثربخشی را با آنزیم تیوردوکسینردوکتاز دارد. ترکیب Au4 نیز با دارا بودن لیگاند تیولاتی بنزوتیازول فعالیت ضدمیکروبی مطلوبی نشان میدهد. داشتن حلقه آروماتیک و وجود گروه نیتروژن در این حلقه نیز باعث افزایش فعالیت سیتوتوکسیک آن شده است، اما از سویدیگر حجیمتر شدن مولکول باعث کاهش فعالیت آن درمقایسه یا Au3 میشود.
ازآنجاییکه مکانیسم اصلی ترکیبات طلای ضدمیکروبی از طریق مهار آنزیم تیوردوکسین ردوکتاز است، بنابراین برهمکنش ترکیبات موردبررسی با این آنزیم در فاز مولکولار مدلینگ بررسی شد. برای بررسی مکانیسم عمل ترکیبات موردمطالعه، داکینگ مولکولی آنها در جایگاه فعال آنزیم تیوردوکسینردوکتاز بررسی شد و نحوه و چگونگی اتصال آنها به آنزیم با داکینگ مولکولی کاملاً مورد بررسی قرار گرفته است. مطالعات داکینگ مولکولی در صورتی موفقیتآمیز خواهد بود که روشهای بهکاررفته در آن اعتبارسنجی شده باشند. در اعتبارسنجی فرایند داکینگ، محقق شیمی دارویی به دنبال پاسخ به این پرسش است که منابع نرمافزاری و روش انتخابشده تا چه میزان توانایی تمیز دادن بین ترکیبات فعال و غیرفعال را دارند. روشهای مختلفی برای اعتبارسنجی فرایند داکینگ و تابع امتیازدهی آن وجود دارد [19].
یک روش متداول، بررسی کانفورماسیون پیشبینیشده در فرایند داکینگ است. در این روش، یک ترکیب با ساختار و جهتگیری مشخص در جایگاه فعال آنزیم (معمولاً ساختار کریستالوگرافی دارای لیگاند)، با استفاده از نرمافزار داکینگ دوباره در جایگاه فعال آنزیم داک میشود. نرمافزاری که کانفورمر پیشبینی شده توسط آن نسبت به ساختار کریستالوگرافی دارای اختلاف مجذور مربع میانگین کمتری باشد (معمولاً بین 1/5 تا Å2 بسته به اندازه لیگاند دارد) فرایند داکینگ را با موفقیت بیشتری انجام داده است. بدینمنظور، ریداکینگ اورانوفین طبق پارامترهای اعمالشده بر ترکیبات مورد مطالعه خود، با 4CBQ بررسی شد. این ترکیب در ساختار آنزیم٬ در جایگاهی بسیار یکسان با حالت کوکریستاله خود قرار گرفت و اختلاف مجذور مربع میانگین بهدستآمده 0/85 Å بوده است.
در سال 2014 تیم تحقیقاتی دکتر ماریا کونتل از دانشگاه بروکلین آمریکا، تعدادی کمپلکس هترو متالیک طلا1- تیولات دربردارنده فروسنیل-فسفین، را سنتز کردند و اثرهای ضدمیکروبی آنها را بر روی باکتریهای مختلف گرم منفی و مثبت و مخمرها بررسی کردند و نتایج را با داروی اورانوفین سنجیدند. این ترکیبات، اثرهای بسیار رضایتبخشی بر روی دسته وسیعی از میکروبهای موردبررسی بهویژه گرم مثبتهای استافیلوکوک اورئوسUS300 و US400 خود نشان دادند. ترکیب Au3 بهعنوان بهترین ترکیب مطالعه حاضر، در قیاس با این مطالعه٬ اثرهای به مراتب بهتری بهویژه روی باکتریهای گرم منفی و مخمرها از خود نشان داد [20].
در سال 2015، تیم تحقیقاتی دکتر کوالسکی از دانشگاه لهستان، به همراه تیم تحقیقاتی سوئیسی، سنتز کمپلکسهای طلا 1-آلکینیل کرومون را ارائه دادند. آنها فعالیت ضدباکتریایی این کمپلکسهای سنتزشده را نیز مورد بررسی قرار دادند. ترکیب Au3 در مقایسه با ترکیبات معرفیشده در این مطالعه اثرهای بسیار بهتری بهویژه روی اشرشیاکلی از خود نشان داد [21].
نتیجهگیری
در این کار، فعالیت ضدمیکروبی 5 عدد کمپلکسهای دی فنیل پیریدین فسفین طلا1-تیولات روی دو گونه باکتری گرم منفی (پسودوموناس آئروژینوزا و اشرشیاکلی)، دو گونه باکتری گرم مثبت (استافیلوکوک اورئوس و باسیلوس سوبتیلیس)، یک گونه قارچ (کاندیدا آلبیکنس) و یک گونه مخمر (ساکارومایسس سرویزیه) مورد ارزیابی قرار گرفتند. این ترکیبات، فعالیت ضدمیکروبی مطلوبی از خود نشان میدهند و دارای قدرت بالایی در مهار رشد سلولهای میکروبی هستند. بهترین ترکیب از میان ترکیبات مجموعه (ترکیبAu3 ) دارای حداقل غلظت مهارکنندگی برابر با 3/89، 3/15، 4/36، 5/44٬ 6/13 و 8/37 میکروگرم بر میلیلیتر بهترتیب روی گونههای پسودوموناس آئروژینوزا، اشرشیاکلی، استافیلوکوک اورئوس، باسیلوس سوبتیلیس، کاندیدا آلبیکنس و ساکارومایسس سرویزیه است. این ترکیبات بهویژه بر روی گونههای گرم منفی و مخمر از داروی ضد آرتریت روماتوئیدی آرونوفین که دارای اتم طلا در ساختار خود است به مراتب بهتر و قدرتمندتر عمل میکنند. مطالعات داکینگ بر روی ترکیبات در جهت پیدا کردن نحوه و چگونگی اتصال و موقعیت آنها در اتصال به آنزیم تیوردوکسین ردوکتاز از نظر انرژی انجام شد. این ترکیبات و بهویژه ترکیب Au3 این قابلیت را دارند تا در مسیر آینده کنترل عوامل میکروبی بهویژه در مواد غذایی، بیشتر مورد توجه قرار گیرند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
مقاله حاضر حاصل بخشی از پایاننامه دکترای حرفهای سالار نصرتی در رشته داروسازی عمومی، گروه شیمی دارویی، دانشکده داروسازی، دانشگاه علوم پزشکی جندیشاپور اهواز میباشد که در حوزه معاونت پژوهشی دانشگاه علومپزشکی جندیشاپور اهواز با کد B-9606 تصویب شده است. کد اخلاق این کار IR.AJUMS.REC.1396.77 است.
حامی مالی
حامی مالی این مطالعه دانشگاه علومپزشکی جندیشاپور اهواز است.
مشارکت نویسندگان
انجام کارهای عملی و تستهای بیولوژیک: سالار نصرتی و نوشتن مقاله و تحلیل دادهها: مسعود فریدوننژاد.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان از دانشگاه علوم پزشکی جندی شاپور اهواز که بودجه این کار را فراهم کردند و نیز گروه شیمی دارویی دانشکده داروسازی که امکانات لازم را در اختیار قرار دادند، تشکر و قدردانی میکنند.
References